Das Periodensystem aus einem Experiment ableiten
Die Beziehung zwischen der Periodizität bestimmter Eigenschaften von Elementen und der zugrunde liegenden atomaren elektronischen Struktur ist oft schwierig zu visualisieren. Um den Zusammenhang zwischen der Hauptquantenzahl und der Ionisationsenergie weiter zu untersuchen, können Sie die erste Ionisationsenergie für die ersten 54 Elemente untersuchen. Wenn die Annahme richtig ist, sollten die ersten Ionisationsenergien auf Gruppen je nach Hauptquantenzahl 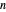 des äußersten Elektrons in jedem Atom entfallen.
des äußersten Elektrons in jedem Atom entfallen.
Die Eigenschaft "IonizationEnergies" gibt eine Liste zurück, also müssen Sie nur die erste Ionisationsenergie extrahieren.
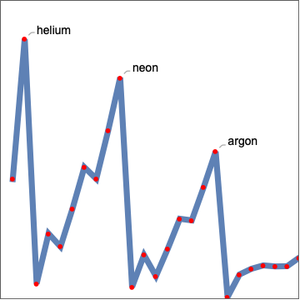
Wie erwartet, fallen die ersten Ionisationsenergien in fünf Gruppen, die der Hauptquantenzahl entsprechen. Die Ionisationsenergie ist nicht die einzige elementare Eigenschaft, die Periodizität aufweist. Untersuchen Sie den Atomradius derselben Elemente.
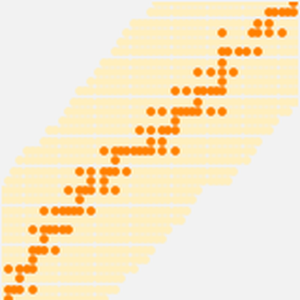
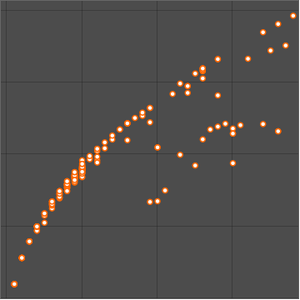
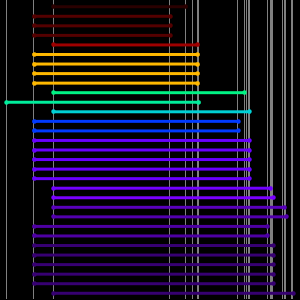
Die Atomradiusdaten fallen in noch übersichtlichere Gruppierungen, die mit der Hauptquantenzahl des äußersten Elektrons im Atom korrelieren. Diese beobachteten Hauptquantenzahl-Gruppierungen deuten auf eine organisatorische Anordnung hin, die ausschließlich auf beobachteten experimentellen Daten basiert. Um diese mögliche organisatorische Anordnung besser zu visualisieren, drehen Sie die Atomradiusdaten, deaktivieren Sie Daten-Callouts und passen Sie das Seitenverhältnis der resultierenden Darstellung an.
Das Ergebnis sind fünf geneigte "Reihen" mit jeweils 2, 8, 8, 8, 8, 18 und 18 Elementen. Wenn man die Zeilen abflach und ein wenig auseinanderzieht, kann man sehen, wie die Standardform des modernen Periodensystems entsteht.