Derive de forma experimental a tabela periódica
A relação entre a periodicidade da propriedade elementar e a estrutura eletrônica atômica subjacente pode ser difícil de visualizar. Para investigar a relação entre o número quântico principal e a energia de ionização, você pode examinar a primeira energia de ionização para os primeiros 54 elementos. Se a suposição estiver correta, as primeiras energias de ionização devem cair em grupos com base no número quântico principal, 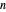 , do elétron mais afastado.
, do elétron mais afastado.
A propriedade "IonizationEnergies" retorna uma lista, então você precisa extrair apenas a primeira energia de ionização.
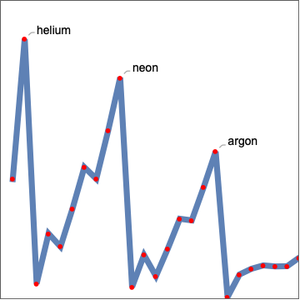
Como esperado, as primeiras energias de ionização se enquadram em cinco grupos correspondentes ao número quântico principal. A energia de ionização não é a única propriedade elementar que exibe periodicidade. Examine o raio atômico para os mesmos elementos.
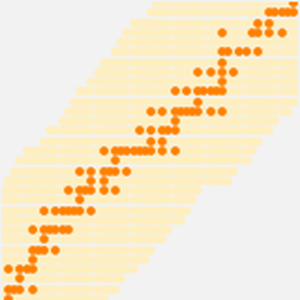
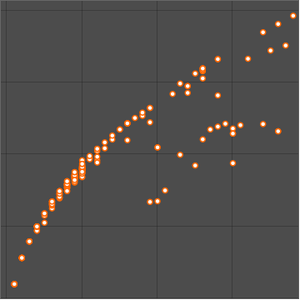
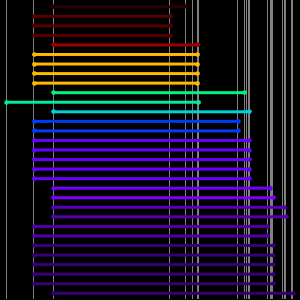
Os dados do raio atômico caem em agrupamentos ainda mais limpos, correlacionando com o número quântico principal do elétron mais afastado.Esses agrupamentos de números quânticos principais observados sugerem um arranjo organizacional baseado apenas em dados experimentais. Para visualizar melhor esse possível arranjo organizacional, gire os dados do raio atômico, desative as chamadas de dados e ajuste a proporção do gráfico resultante.
Os resultados são cinco "linhas" inclinadas contendo 2, 8, 8, 18 e 18 elementos, respectivamente. Se você nivelar as linhas e separá-las um pouco, é possível ver a forma padrão da tabela periódica começando a surgir.