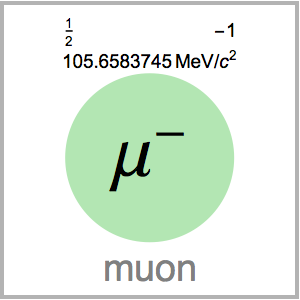
Derivación experimental de la tabla periódica
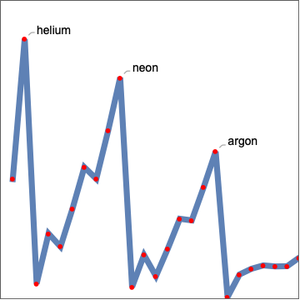
La relación entre la periodicidad de las propiedad elementales y la estructura atómica electrónica subyacente puede ser difícil de visualizar. Para investigar más a fondo la relación entre el número cuántico principal y la energía de ionización, puede examinar la primera energía de ionización para los primeros 54 elementos. Si la suposición es correcta, las primeras energías de ionización deberían dividirse en grupos según el número cuántico principal, 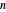 , del electrón más externo en cada átomo.
, del electrón más externo en cada átomo.
La propiedad "IonizationEnergies" devuelve una lista, por lo que necesita extraer solo la primera energía de ionización.
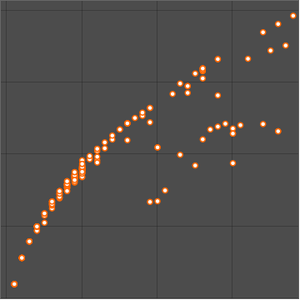
Como se esperaba, las primeras energías de ionización se dividen en cinco grupos correspondientes al número cuántico principal. La energía de ionización no es la única propiedad elemental que exhibe periodicidad. Examine el radio atómico para los mismos elementos.
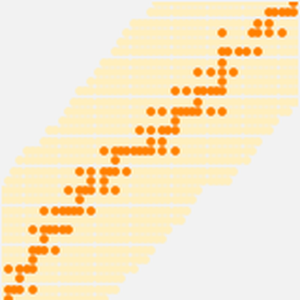
Los datos del radio atómico son divididos en conjuntos aún más definidos, correlacionados con el número cuántico principal del electrón más externo en el átomo. Estas agrupaciones de números cuánticos principales observadas sugieren un arreglo organizativo basado únicamente en datos experimentales observados. Para visualizar mejor esta posible organización, rote los datos del radio atómico, desactive las notificaciones de datos y ajuste la relación de aspecto del gráfico resultante.
Los resultados son cinco "filas" inclinadas que contienen 2, 8, 8, 18 y 18 elementos respectivamente. Si aplana las filas y entrecierra los ojos, puede ver que comienza a surgir la forma estándar de la tabla periódica moderna.